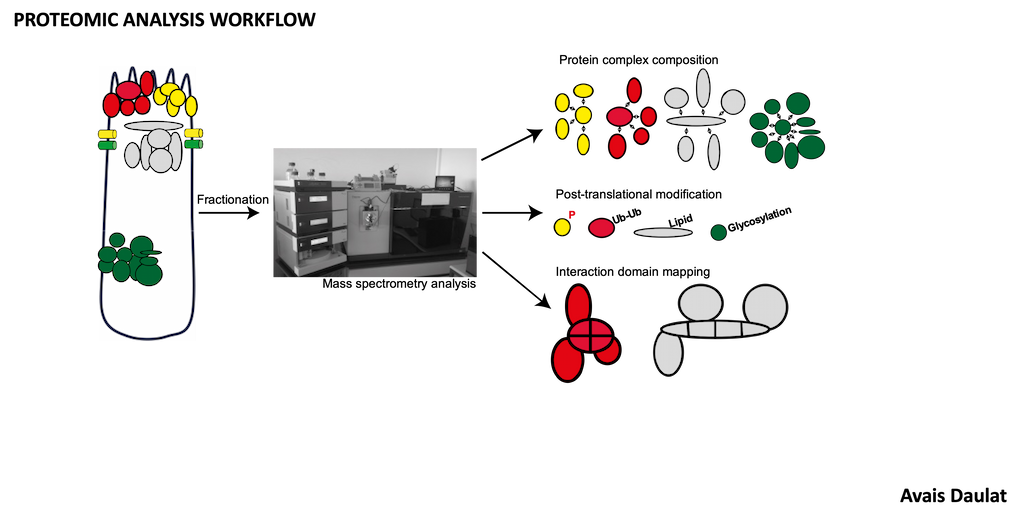
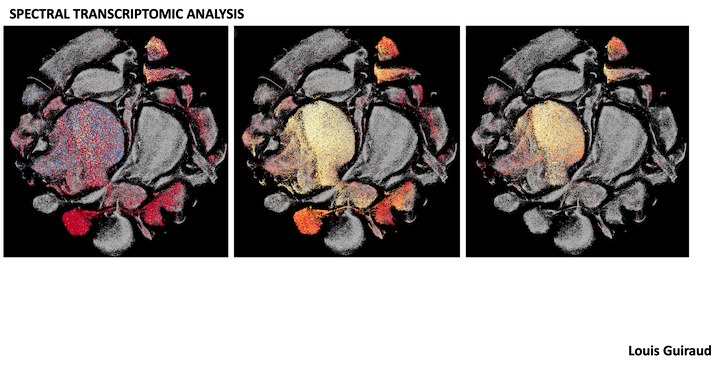
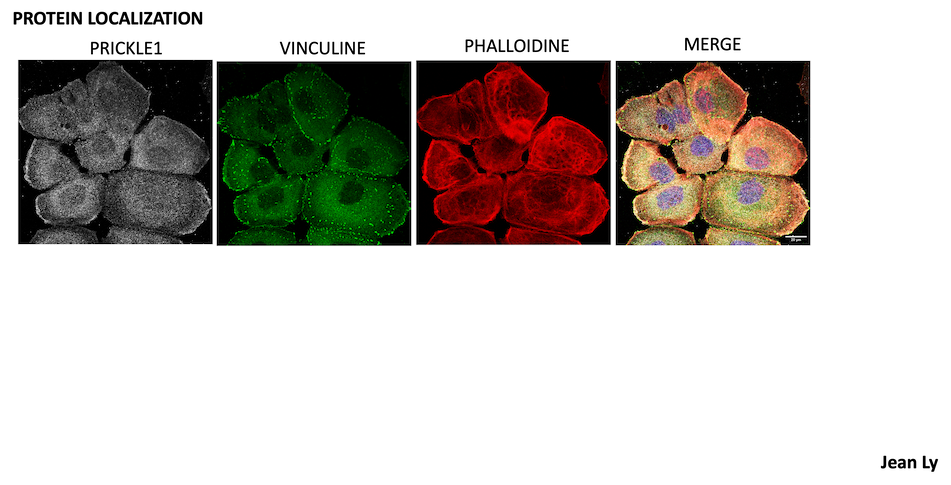
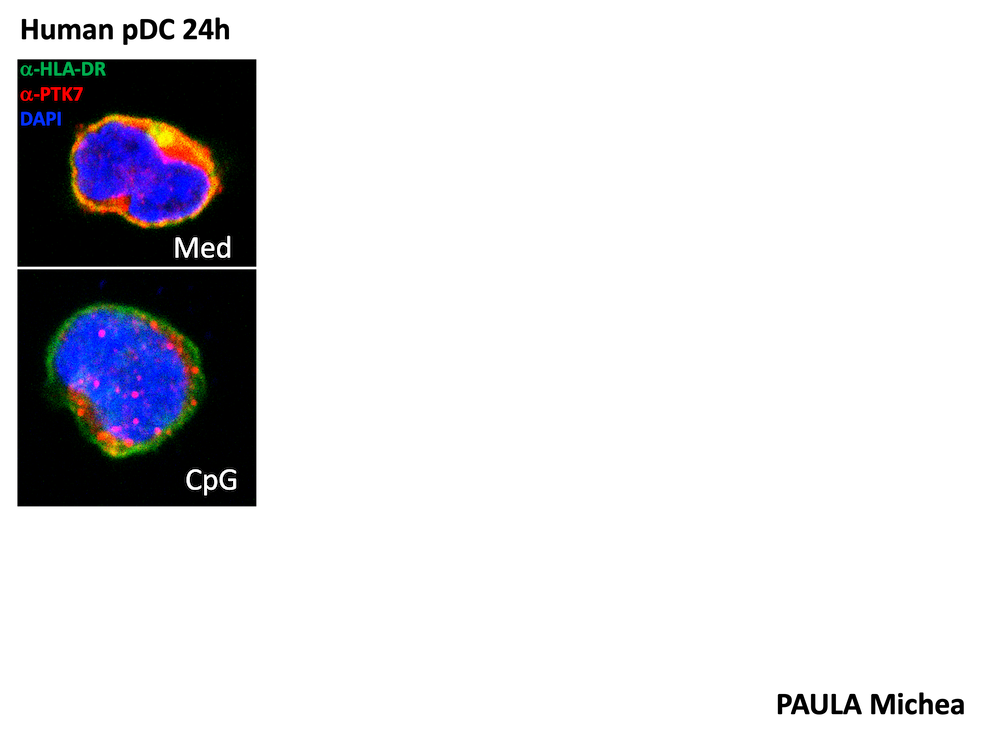
Notre équipe Ciblage des réseaux de signalisation et du microenvironnement dans le cancer, étudie la signalisation cellulaire dans le cancer pour identifier les vulnérabilités qui seront les cibles des médicaments de demain.
Les études sont réalisées à l’aide de stratégies complémentaires combinant des approches moléculaires, biochimiques et multi-omiques ainsi que cellulaires, complétées par l’utilisation de modèles ex vivo et in vivo récapitulant la complexité du processus tumoral. Nos études bénéficient également de méthodologies interdisciplinaires incluant la biologie computationnelle, la modélisation mathématique et la physique.
Nous explorons les voies de signalisation dans les cancers de mauvais pronostic, dès l’initiation de la tumeur et tout au long de sa progression, en exploitant des vulnérabilités pour le développement de thérapies ciblées.
Les thèmes de l’équipe s’articulent autour de deux axes principaux :
Axe 1 : Voies de signalisation membranaires dans les cellules tumorales.
Nous nous focalisons sur les voies de signalisation peu caractérisées dans le cancer aux niveaux moléculaire et fonctionnel. Il est important de noter que ces signaux représentent de nouvelles cibles potentielles contre lesquelles nous développons des molécules bioactives.
Nous explorons notamment les aspects suivants :
- l’organisation moléculaire des voies de signalisation,
- les bases moléculaires du déclenchement et de la progression du cancer (dissémination des cellules, migration collective des cellules, résistance aux traitements, …) et du microenvironnement tumoral ;
- la génération de molécules inhibitrices à potentiel thérapeutique.
Axe 2 : Modélisation et ciblage des interactions entre les cellules cancéreuses et leur microenvironnement tumoral : vers des perspectives translationnelles.
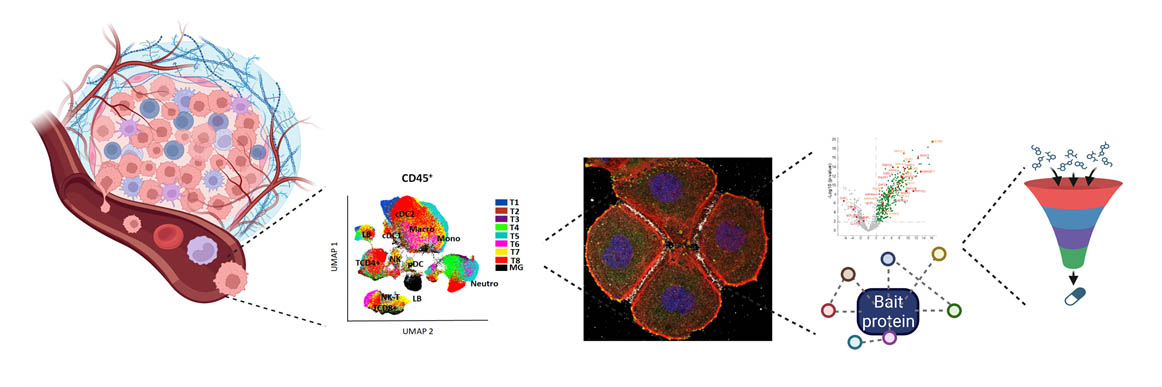
Cet axe explore l’implication de nouveaux gènes/mécanismes impliqués dans le dialogue entre les cellules cancéreuses et leur microenvironnement, en particulier les cellules immunitaires. Notre stratégie est basée sur la combinaison de données provenant de patients et de modèles de cancer ex vivo (organoïdes/tumoroïdes) dérivés d’échantillons tumoraux, étudiés à l’échelle de la cellule unique, et in vivo.
Les projets
Nous explorons des voies de signalisation dont les fonctions et mécanismes d'action restent largement inconnus. Ces voies pourraient représenter des cibles potentielles pour de nouveaux traitements anticancéreux. Parmi nos axes d'étude :
- Les relations mécanistiques entre les multiples réseaux de signalisation.
- La régulation des processus biologiques dans les cellules cancéreuses (initiation, dissémination, migration collective, résistance aux traitements, etc.) et leur microenvironnement.
- La conception de stratégies optimisées pour la génération d'agents bloquants.
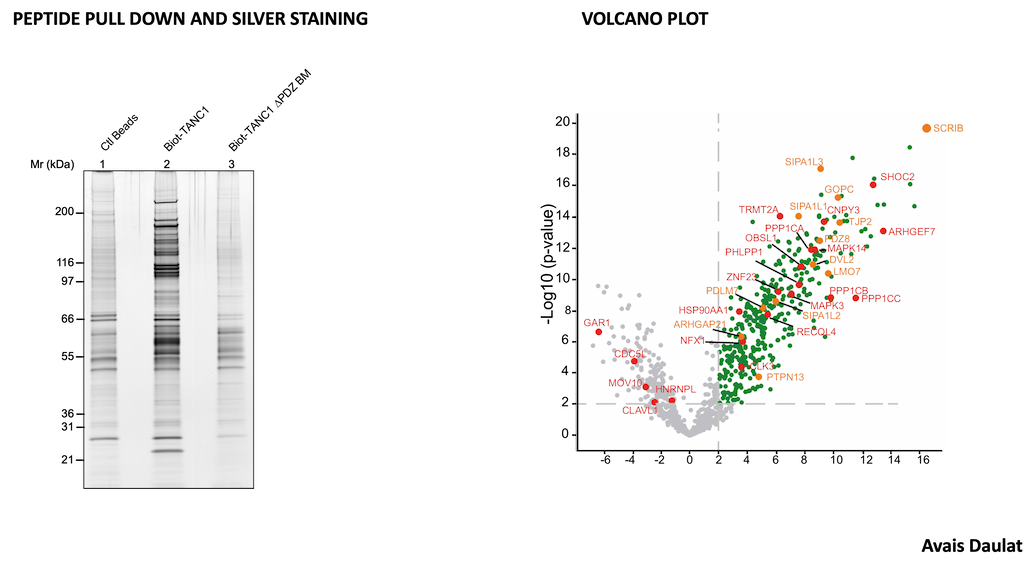
La voie de signalisation WNT/polarité cellulaire planaire (PCP) joue un rôle clé dans les stades précoces et tardifs du cancer. Nous avons documenté son mode d'action dans les cancers agressifs et exploré des stratégies pour cibler ses composants membranaires ou sub-membranaires.
1.1 VANGL2 est un récepteur de la voie WNT/PCP associé à un mauvais pronostic dans le cancer du sein triple-négatif (TNBC). Nos travaux récents ont montré :
- La co-purification de VANGL2 avec un récepteur GPCR de la voie WNT/PCP.
- Une association entre l'expression de ce GPCR et une diminution de la survie sans métastases.
Nos objectifs actuels incluent :
- Étudier l'organisation moléculaire du complexe VANGL2/GPCR.
- Développer des anticorps pour détecter le GPCR actif dans des biopsies.
- Analyser la signalisation en aval de VANGL2 et du GPCR.
- Créer des modulateurs pharmacologiques ciblant le GPCR.
1.2 MINK1 est une kinase impliquée dans la croissance tumorale et la dissémination des cellules cancéreuses. Nos travaux actuels incluent :
- Développement d'inhibiteurs de MINK1.
- Création de biomarqueurs pour prédire l'efficacité des inhibiteurs.
- Analyse de la signalisation MINK1 par spectrométrie de masse.
- Évaluation des inhibiteurs dans des modèles murins et PDX de TNBC.
1.3 PTK7 est un récepteur pseudo-kinase impliqué dans les voies WNT/PCP et WNT/β-caténine. Nous avons développé des petites molécules inhibitrices et travaillons à :
- Explorer les relations structure-activité des inhibiteurs.
- Tester leur efficacité dans le cancer colorectal.
1.4 ADAMTSL5 est une glycoprotéine sécrétée impliquée dans divers cancers. Nos travaux montrent que son inhibition réduit l'agressivité tumorale. Actuellement, nous :
- Confirmons ADAMTSL5 en tant que biomarqueur.
- Analysons son complexe protéique et son mécanisme d’action.
- Étudions son impact sur le microenvironnement tumoral.
- Développons des agents pour son diagnostic et son ciblage.
Cet axe vise à explorer l'implication de nouveaux gènes/mécanismes candidats dans le dialogue entre les cellules cancéreuses et leur microenvironnement, en particulier avec les cellules immunitaires. Il est basé sur la combinaison d'ensembles de données et d'échantillons provenant de patients avec des modèles de cancer ex vivo (organoïdes/tumoroïdes), à cellule unique et spatiaux, et in vivo.
2.1. Étude des interactions immunitaires dans le TNBC
En nous concentrant sur le TNBC, nous utilisons des modèles uniques de cancer in vivo pour explorer la composition des différents types de cellules immunitaires présents dans le microenvironnement tumoral et leur interaction avec les cellules cancéreuses. Nous reconstituons et ciblons ces interactions in vivo en développant des modèles orthotopiques chez des souris syngéniques dont le système immunitaire est intact. Les résultats sont systématiquement comparés aux contextes observés chez les patients. En outre, nous explorons longitudinalement comment des traitements anticancéreux distincts peuvent conduire à un remodelage immunitaire spécifique, ceci en fonction du type de traitement. Ces études sont réalisées avec des analyses dynamiques plutôt que statiques, afin de comprendre comment le remodelage immunitaire peut influencer le choix le plus pertinent des immunothérapies. Nous anticipons que l’acquisition de ces connaissances pourront aider à la conception de nouvelles combinaisons d'agents anticancéreux et d'immunothérapies.
2.2. Analyse des lésions tumorales précoces
Nous avons rassemblé une série de données préliminaires indiquant que les lésions tumorales précoces sont caractérisées par des caractéristiques cellulaires et moléculaires qui diversifient leur comportement au fil du temps (quiescent versus évolutif). En nous concentrant sur le cancer du foie, nous étendons ces études en utilisant des modèles murins uniques de tumorigenèse spontanée, récapitulant l'hétérogénéité moléculaire ainsi que temporelle de l'apparition de la tumeur. Nous avons documenté la possibilité d'utiliser la tomographie assistée par ordinateur à comptage de photons (PC-CT ; établie par nos collaborateurs en physique du CPPM) pour suivre longitudinalement les tumeurs endogènes. Les lésions quiescentes et évolutives sont analysées par cytométrie spectrale et par single cell RNAseq, afin de découvrir les caractéristiques moléculaires et cellulaires qui diversifient un comportement évolutif ou quiescent des lésions pré-néoplasiques. Nous évaluons la robustesse des résultats sur le plan fonctionnel à l’aide de modèles ex vivo et in vivo, et sur le plan clinique en analysant des données et des échantillons de patients.
2.3. Rôle de PTK7 dans les interactions tumeur-hôte
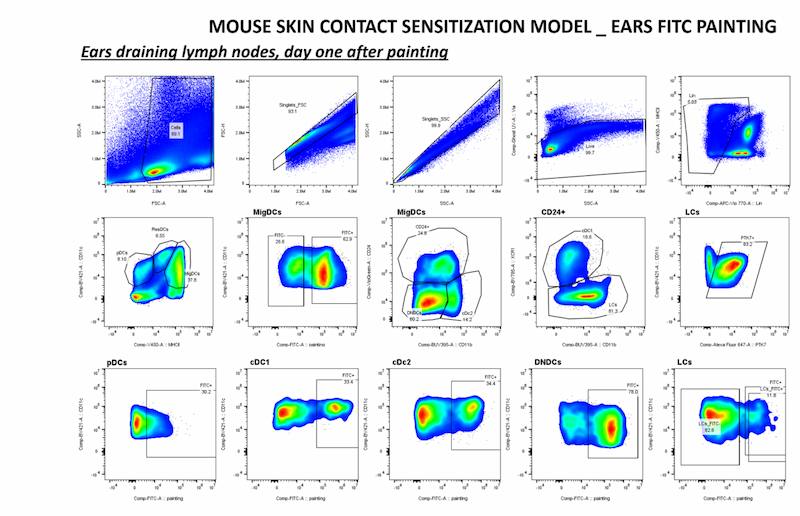
Nous avons récemment découvert que PTK7 est exprimée dans les cellules dendritiques (DC), en particulier les cellules de Langerhans (peau, ganglions lymphatiques cutanés) chez la souris. En outre, l'expression de PTK7 a également été observée dans les monocytes infiltrant la tumeur, les pDC, les cDC2 et les cDC1 dans les modèles murins de mélanome et de cancer du sein, ce qui suggère que PTK7 peut être modulé par le microenvironnement tissulaire.
En utilisant un modèle de souris unique et des données -omiques multiparamétriques, nous :
- étudions la fonction physiologique de PTK7 dans les cellules dendritiques (DC) ;
- déterminons le rôle des DC exprimant PTK7 dans le cancer du sein. Nous avons identifié l'expression de PTK7 dans les fibroblastes du côlon et des niveaux accrus dans le CCR murin et humain. Nous avons généré des souris déficientes en PTK7 dans un sous-ensemble de fibroblastes du côlon et révélé une susceptibilité à la colite aiguë et à une probable tumorigenèse.
Ces résultats indiquent un rôle essentiel de PTK7 dans le dialogue entre l'épithélium colique et les fibroblastes. Nous sommes actuellement en train de :
- documenter l’implication de PTK7 dans le dialogue entre l'épithélium colique et les fibroblastes pendant l’homéostasie du tissu ;
- caractériser moléculairement et fonctionnellement des différents compartiments cellulaires régulés par PTK7 à l'aide de modèles murins pertinents et d'organoïdes humains ;
- déterminer les partenaires de liaison de PTK7 dans les compartiments épithéliaux et fibroblastiques en utilisant un modèle de souris "knock-in" PTK7-BirA* dans la carcinogenèse du côlon ;
- déchiffrer la contribution des fibroblastes exprimant PTK7 dans la tumorigenèse du cancer du côlon ;
- valider l'expression de PTK7 et les altérations identifiées chez la souris en tant que marqueurs pronostiques chez les patients atteints de cancer du côlon.
Les actualités de l’équipe
les publications à la une
06/2024
Dessaux C, Ganier L, Guiraud L, Borg JP.
04/2024
Walton A, Thomé V, Revinski D, Marchetto S, Puvirajesinghe TM, Audebert S, Camoin L, Bailly E, Kodjabachian L, Borg JP.
11/2022
Sequera C, Grattarola M, Holczbauer A, Dono R, Pizzimenti S, Barrera G, Wangensteen KJ, Maina F.
09/2022
Daulat AM, Wagner MS, Audebert S, Kowalczewska M, Ariey-Bonnet J, Finetti P, Bertucci F, Camoin L, Borg JP.
09/2021
Castellanet O, Ahmad F, Vinik Y, Mills GB, Habermann B, Borg JP, Lev S, Lamballe F, Maina F.
04/2021
Arechederra M, Bazai SK, Abdouni A, Sequera C, Mead TJ, Richelme S, Daian F, Audebert S, Dono R, Lozano A, Gregoire D, Hibner U, Allende DS, Apte SS, Maina F.


Labels, Financements et Partenaires
Comme d'autres, ils ont fait partie de l'équipe. Merci à tous ceux qui ont contribué à l'excellence et à l'impact du CRCM.